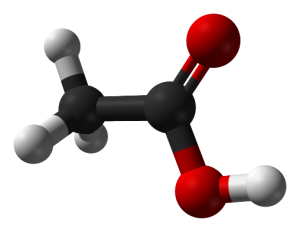
| نام گذاری آیوپاک:اتانوئیک اسید |
| دیگر نام ها:
استیل اسید
اتلیک اسید
هیدروژن استات
متانوکربو کسیلیک اسید |
| ساختار |
| گشتاور دو قطبی D 1.74 (گاز) |
| خصوصیات |
|
| فرمول مولکولی |
C2H4O2 |
| جرم مولی |
g mol-1 60/05 |
| شکل ظاهری |
مایع بی رنگ |
| چگالی |
(g/cm3(I 1.049
(g/cm3(s 1.266 |
| دمای ذوب |
16.5 درجه سلسیوس (7/61 درجه فارنهایت ;6/289 کلوین ) |
| دمای جوش |
118.1درجه سانتی
گراد/391کلوین/245درجه فارنهایت |
| انحلال پذیری در آب |
قابل امتزاج به هر نسبت |
| اسیدی((pKa |
4.76 |
| گرانروی |
Mpa.s at 25˚c 1.22 |
| خطرات |
|
| طبقه بندی ئی یو |
مضر(xn)خورنده(C)آتش گیر(F) |
| کدهای ایمنی |
R10/R35 |
| شماره های نگهداری |
S1/2),S23,S26,S45 |
| نقطه اشتغال |
c˚43 |
| LD50 |
(mg/kg,oral(rat3310 |
چیز هایی که در باره اسید استیک یاد میگیریم :
- کاربرد ها
- خواص شیمیایی
- حلال
- واکنش های شیمیایی
- شناسایی
- تاریخچه
- ایمنی
نگاه کلی
استیک اسید جز اسید های کربوکسیلیک می باشد ودر نامگذاری آیوباک به اسید اتانوئیک معروف است این اسید دارای فرمول شیمیایی می باشد و در قسمت چشایی طعم ترشی شبیه طعم سرکه دهد.
این اسید یک اسید ضعیف بوده زیرا تنها مقداری اسید جدا شده در محلول آبی می باشد استیک اسید بدون اب و خالص (استیک اسید یخی ) یک مایع بدون رنگ بوده که آب را از محیط اطرافش جذب میکند (هیگروسکوبی )و در دمای 16.5 (62F)به شکل یک جامد کریستالی بی رنگ منجمد می شود اسید خالص و محلول های غلیظ آن بسیار خورنده هستند
استیک اسید یکی از ساده ترین کربکسیلیک اسید ها است این اسید یک معرف شیمیایی مهم بوده و یک ماده شیمیایی صنعتی مورد استفاده در تولید مواد زیر است :پلی اتیلن ترفتالات که به صورت عمده در بطری های نوشابه استفاده میشود:سلولوز استات که به طور عمده در فیلم عکاسی استفاده می شود پلی ویتیل استات برای چسب چوب به علاوه فایبرها و فابریک های مصنوعی درخانه استیک اسید رقیق برای باز کردن لوله ها استفاده میشود در صنعت غذا استیک اسید تحت کد E260به عنوان تنظیم اسیدی و به عنوان چاشنی استفاده میشود.
تقاضای جهانی استیک اسید در حدود 5/6 میلیون تن (متربک تن در سال mt/a) که حدود 1.5 mt/a از طریق بازیافت برآورده می شود باقی آن توسط بازار خوراک پترو شیمیایی تولید می شود استیک اسید رقیق تولید شده توسط تخمیر طبیعی سرکه نامیده می شود
باکتری های مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدند این باکتری ها در مواد غذایی آب و خاک یافت میشود اسید استیک به طور طبیعی از میوه ها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشود و از قدیمی ترین ترکیبات شیمیایی شناخته شده توسط انسان می باشد
کاربرد هایی استیک اسید
- تولید ترکیبات شیمیایی
اسید استیک به عنوان یک معرف شیمیایی برای تولید تعدادی ترکیب شیمیایی استفاه می شود این است که عمدتا در تولید وینیل استات مونومور آنیدرید استیک و استر استفاده می شود .
- خالص سازی ترکیببات آلی
برای خلص سازی ترکیبات آلی اسید استیک به عنوان یک حلال برای کریستال شدن استفاده می شود
- استفاده پزشکی
اسید استیک می تواند به عنوان یک ضد عفونی کننده در برابر
Pseudomonas استافیلوکوک انتروکوک استر پتوکوک و دیگران استفاده می شود همچنین در غربالگری سرطان رحم استفاده می شود سازمان بهداشت جهانی اسید استیک را در فهرست دارو های ضروری خود فهرست کرده است همچنین برای درمان عفونت گوش خارجی مانند رشد قارچ و باکتری استفاده میشود
- بعنوان افزودنی مواد غذایی
از استیک اسید در سرکه استفاده میشود که بعنوان یک مکمل در ترشی و سبزیجات خام و سایر مواد غذایی مورد استفاده قرار میگیرد
- تولید جوهر و رنگ
اسید استیک برای تولید جوهر و رنگ استفاده می شود
- صنعت عطر
اسید استیک در ساخت عطر نیز استفاده می شود
خواص شیمیایی
قدرت اسیدی اتم هیدروژن (H)در گروه کربوکسیل (ــCOOH) در اسید های کربوکسیلیک همچون اسید استیک می توانید به عنوان یک یون (پروتن)H
+ آزاد شود و به آنها خاصیت اسیدی دهد اسید استیک در محلول های آبی یک اسید تک برونونی موثر است با ارزش ثابت تفکیک اسیدی (Pk
a)آن PH&:4/8 A nbsp 0.1 مولاریته محلول آن (در حدود انسجام سرکه خانگی )2/4 است که نشان می دهد 4.0 درصد از ملکول های اسید استیک تفکیک یافته اند
ساختار کریستالی اسید استیک نشان می دهد که ملکول ها به صورت دی مر جفت می شوند که پیوند های هیدروژنی آن ها را به هم متصل می کنند دی مر ها می توان در بخار 120 درجه سانتی گراد شناسایی کرد این حالت ممکن است در فاز مایع اسید استیک خالص نیز رخ می دهد اما در صورت وجود آب به سرعت به هم می ریزید سایر اسید های کربو کسیلیک پایین تر نیز این رفتار دی مر سازی را دارند
حلال
اسید استیک مایع مانند آب واتانول یک حلال پروتن دارآبدوست(مولکول قطبی|قطبی)است. این ماده با ثابت دی الکتریک 6/2 می تواند علاوه بر حل کردن ترکیبات قطبی همچون نمک های معدنی و و شکرها ترکیبات غیر طببیعی همچون روغن ها و عناصر ها شیمیایی مثل سولفور و آیودین را در خود حل میکند این ماده با بسیاری از حلال های قطبی و غیر قطبی همچون آب کلروفورم وهگزان مخلوط می شود این خاصیت انحلال و امتزاج پذیری اسید استیک آن را به یک ماده شیمیایی پرکاربرد صنعتی تبدیل کرده است
واکنش های شیمیایی
اسید استیک برای بسیاری از فلزات از جمله آهن میزیم و روی خاصیت خورندگی دارد و در واکنش با آنها گاز هیدروژن و نمک های فلزی به نامم استانها تولید میکند با قرار گرفتن آلومینیوم در معرض اکسیژن یک لایه نازک از اکسید آلومینیوم بر روی سطح آن ایجاد می شود که نسبتا مقاوم است در نتیجه تانکر های آلومینیومی در حمل و نقل اسید استیک مورد استفاده قرار میگیرد استات های فلزی را می توان از واکنش اسید استیک با یک بار با یک بار نیز بدست آورد که نمونه مشهور آن واکنش های شیمیایی عادی یک اسد کربوکسیلیک درمورد اسید استیک اتفاق می افتد که تشکیل اتانول از طریق کاهش و تشکیل مشتقاتی هچون کلرید استیل از طریق استخلاف هسته دوست اسیل از موارد قابل توجه آن هستند دیگر مشقات استخلافی عبارتند از آنیدرید های استیک این آنیدرید از طریق از دست دادن آب در دو مولکول اسید استیک رخ می دهد به همین ترتیب استر های اسید استیک می توانند از طریق استری کردن فیشری تشکیل شوند و آمید ها نیز به همین ترتیب بوجود می اید در صورتی که اسید استیک در معرض حرارت بالای 440 درجه سانتی گراد قرار میگیرد تجزیه شدن آن دی اکسید کربن و متان یا کتن و آب تولید میشود .
شناسایی
اسید استیک را می توان از طریق بوی خاص آن شناخت یک واکنش رنگی برای نمک ها اسید استیک محلول کلرید آهن 3 است که رنگ قرمز سیر ایجاد می کند که پس از اسید سازی ناپدید می شود استات ها وقتی با تری اکسید آرسنک از اکسید کاکودیل حرارت داده میشود از طریق بوی بدی که تولید می کنند قابل شناسایی هستند
تاریخچه
استیک اسید یکی از قدیمی ترین ماده هایی است که بشر کشف کرده زیرا در دوران باستان انسان ها هنگام تهیه شراب از فرایند تخمیر به وجود سرکه پی برده بودند فیلسوف یونانی تئوفار استوس در قرن 3 پیش از میلاد واکنش بین کربنات سرب و زاج های سبز ایجاده ار نمک های مس وستات مس را توسط شیرین شراب ناشی ارز استات سرب بوده است که امروزه دانشمندان مرگ زودرس بسیاری از اشراف رومی رامصرف همین نوع شراب و وجود استات سرب ان می دانند نخستین بار دانشمندان عصر رنسانس استیک اسید گلایسیال را از تقطییر خشک استات های فلزی تهیه کردند و در سال 1847 همون کولب شیمدان آلمانی اسید استیک را از مواد معدنی سنتز کرد
ایمنی
اسید استیک غلیظ خورنده است و در نتیجه باید با احتیاط با آن کاری را انجام داد زیرا باعث سوختگی و اسیب شدید به چشم ها شود به طوری این آسیب دائمی است و باعث سوزش اعضای دارای مایعات مخاطی می شود این تاول ها یا آبله ها ممکن است تا چند ساعت پس از در معرض نور خورشید قرار گرفت ظاهر نشوند به هنگام کار کردن با این اسید و ترکیبات باید از دستکش های مقاوم از جنس پلاستیک و نیتریل استفاده کرد چرا که استفاده از دستکش های لاتکس از ایمنی های لازم برخور دار نیست اسید استیک غللیظ در شرایط آزمایشگاهی به شختی مشتعل میشود با بالا آمدن دما از مرز 39 درجه سانتی گراد ریسک تبدیل ان به یک ماده انفجاره در مجاورت هوا افزایش می یابد
حد انفجار: 4.5 درصد تا 16 درصد
خطر محلول های اسید استیک به مبزان غلظت آن بستگی دارد محلول هایی که اسید استیک آنها بیش از 25 درصد است به خاطر بوی زننده و بخار خورنده انها در هودبخار نگهداری می شود اسید استیک رقیق به شکل سرکه بی ضرر است با این حال وارد کردن محلول های قویتر در آن برای انسان و حیوانات ضرر دارد این محلول به سیتم گوارش آسیب زده و تغیری مهلک را در خاصیت اسیدی خون ایجاد می کند به دلیل عدم تظبیق آن پیشنهاد می شود که اسید استیک را از اسید کرومیک و اتیلن گلایکول و اسید نیتریک و اسید پرکلریک و پر منگنات و پر اکسید و هیدروکسیل ها دور نگه دارید










